咨询热线
400-810-0881
IHC实验疑难解析大汇总
本周小编将带来IHC系列培训的最后一讲,IHC实验中各种常见问题的原因分析和解决方案。希望通过本次课程,您可以了解到 IHC 实验中出现异常情况时您可采取的措施。
一、切片无染色
IHC 中可能遇到的一个主要问题是无染色。出现这一问题的原因主要有三个:
蛋白表达量低/无表达
样本制备不良
试剂/方案问题
1、表达量低/无表达
确定目标蛋白的表达量,用工具查询,Uniport官网: https://www.uniprot.org/
了解目标蛋白表达的种属特异性和组织特异性,有时候目标蛋白在一些常见种属(如:人)有表达,并不表示在其他种属上也有表达。
解决方案:
在实验前查询文献,确定您待检测的目标种属和组织的表达量情况;
http://www.proteinatlas.org/,在这个网站上会提供人体组织的不同蛋白RNA表达数据和IHC数据,可以作为参考;
在实验方案中添加阳性对照组织样本,验证实验体系的正确性;
阳性对照的细胞系,一些情况下,可以选择确定会表达目标蛋白的细胞系作为阳性对照;
质量优良的抗体说明书上会给出建议的阳性对照样本,可以作为参考。
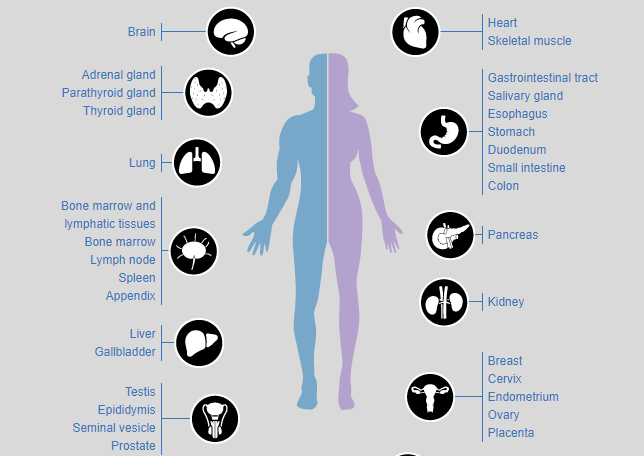
图1、人体不同组织的表达分布,来源:proteinatlas官网
2、样本制备不良
固定步骤:过度固定组织或固定时间不够;固定时使用福尔马林和多聚甲醛固定剂可能会遮蔽抗体识别的表位。
解决方案:
用不同的抗原修复方法暴露表位(用 pH 6 或 pH 9 缓冲液热修复、酶修复等)。
如果过度固定,则需要缩短固定时间。
可能脱蜡不充分
解决方案:
延长脱蜡时间,且需要使用新鲜二甲苯。
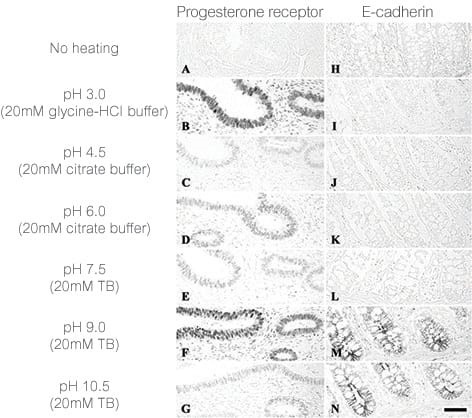
图2 、不同修复液对染色效果的影响
3、试剂/方案问题
一抗问题:
浓度太低:按照说明书上的建议,梯度稀释抗体后实验,选择合适的浓度。
孵育时间不够:尝试在 4°C 孵育更长时间(例如过夜)。
抗体可能不适用于IHC应用,因为其可能无法识别蛋白质的天然(3D)构象。
检查抗体数据表,查看其是否在 IHC 中得到了验证及其 IHC 的类型(石蜡切片、冰冻切片等)。抗体在免疫细胞化学(ICC)或免疫沉淀(IP)中的成功使用暗示了抗体能够识别蛋白质的天然构象。
二抗问题:
使用的二抗为抗一抗宿主的抗体(例如,如果在兔中生产一抗,则使用抗兔二抗)。检查一抗的亚型是否被二抗识别。
用其他蛋白的一抗检测二抗效果,确保二抗正常使用。
二、高背景
免疫组化染色之后的高背景是困扰很多实验者的常见现象,如果您遇到类似问题,可以对照下表的分析,尝试相应的解决方案。
|
可能的问题原因 |
解决方案 |
|
没有封闭或封闭不足 |
|
|
一抗浓度可能过高 |
滴定抗体至最佳浓度,进一步稀释抗体并在 4℃ 孵育(缓慢孵育,但有针对性地结合效果最佳)。
|
|
孵育温度可能过高 |
|
|
二抗可能是非特异性结合 |
|
|
组织冲洗不充分,仍残留固定剂 |
|
|
内源性过氧化物酶具有活性 |
|
|
检测系统是荧光显微镜,固定过程引起自发荧光 |
|
|
信号扩增过多(间接技术) |
|
|
应用过多底物(酶检测) |
|
|
色原与组织样本中PBS 反应(酶检测) |
|
|
通透破坏细胞膜并去除膜蛋白(膜蛋白) |
|
三、非特异性染色
非特异性染色也是小编在日常工作中被问到频率较高的问题,希望下面这些建议一次性解答您的各种疑问。
一抗/二抗浓度可能过高。
尝试降低抗体浓度和/或缩短孵育期。可以与不表达靶蛋白的阴性组织进行比较。
内源性过氧化物酶具有活性。
用酶抑制剂,使用左旋咪唑 (2 mM) 抑制碱性磷酸酶,或用 H2O2 (0.3% v/v) 抑制过氧化物酶。
一抗是抗染色组织来源物种的抗体(例如在小鼠组织样本上使用小鼠一抗)。当应用二抗时,其与组织样本结合,因为其为抗该种属抗体。
使用的一抗为针对与您组织来源物种不同物种的抗体。
使用商业化试剂盒(例如,mouse on mouse 试剂盒:ab127055)。
切片/细胞已经干燥。
将切片/细胞保持在高湿度下以防变干。
总结
您现在应该已经完全了解了 IHC 的常见疑难问题知识,包括:
1、切片无染色的原因及解决方法;
2、遇到高背景染色结果时的处理方案;
3、排除非特异性染色时的做法。
希望您通过这次系列培训了解所有相关实验知识,使您可以顺利完成所有实验。IHC 的培训到这里就结束了。请务必把这些信息保存在安全的地方,以备日后参考。
本文内容来源于abcam官网。
中源生物是Abcam公司授权的一级代理商
如有相关问题请拨打免费服务电话咨询
400-8100-881
如您对我们的服务有任何的意见和建议请发至如下邮箱
service@sinozhongyuan.com
 京公网安备11010502040370号 技术支持:青云软件
京公网安备11010502040370号 技术支持:青云软件